
信达生物昨日宣布,国家药品监督管理局(NMPA)已受理公司在研药物贝伐珠单抗注射液生物类似药(IBI-305)的新药上市申请(NDA)。
IBI-305是信达生物制药自主研发的重组抗血管内皮生长因子(VEGF)人源化单克隆抗体注射液,用于非小细胞肺癌和结直肠癌等恶性肿瘤。原研药贝伐珠单抗注射液自上市以来,全球已批准用于治疗包括非小细胞肺癌在内的多个恶性肿瘤,其显著的疗效和良好的安全性已得到普遍认可。恶性肿瘤的治疗在中国存在着巨大的未被满足的临床需求,由于贝伐珠单抗注射液在中国相对昂贵的价格,其治疗费用仍然超出了普通患者的承受能力。
据悉,这是继达伯舒®(信迪利单抗注射液,于2018年12月24日正式获批上市)和阿达木单抗生物类似药(IBI-303)之后,公司第三个获得NMPA受理的新药上市申请。另外,信达生物制药创始人、董事长兼总裁俞德超博士表示:“作为信达生物申报上市的第3个产品,我们非常高兴IBI-305的新药上市申请获得NMPA受理。目前我们共有13个产品进入临床试验,其中4个产品进入临床III期研究,公司申报的第一个产品达伯舒®成功获批上市。
关于非小细胞肺癌和结直肠癌
中国抗癌协会组织编写的《中国恶性肿瘤学科发展报告(2017年)》指出,中国恶性肿瘤发病率约占世界22%,发病人数居全球第一。中国肺癌发病率和死亡率分别占全球的35.78%和37.56%,已成为世界上肺癌发病最多的国家,是中国增长最快的恶性肿瘤。非小细胞肺癌占整个肺癌的80%左右。晚期结直肠癌的发病率也比较高,且呈逐年上升趋势。
大量的基础研究和临床研究结果显示,血管生成在恶性肿瘤的发病机制中起到重要的作用,且原研药贝伐珠单抗的多个大型确证性临床试验数据充分地证实了其在非小细胞肺癌和结直肠癌等七种实体瘤中的临床疗效和良好的安全性。原研药已在中国获批非小细胞肺癌和结直肠癌两个适应症。
关于贝伐珠单抗及其生物类似物市场情况
贝伐珠单抗注射液(Bevacizumab)由瑞士罗氏公司研制开发,商品名为安维汀(Avastin)。采用哺乳动物细胞表达的抗人血管内皮生长因子(VEGF)单克隆抗体制剂,通过阻断VEGF与其内皮细胞上的受体结合,使VEGF失去生物活性,从而减少肿瘤血管生成,抑制肿瘤生长。2004年2月首先被美国FDA批准上市,与5-氟尿嘧啶化疗联合用于转移性结直肠癌患者的治疗,是全球首个批准的靶向作用于VEGF的药物。之后陆续批准用于非小细胞肺癌、肾癌、脑胶质瘤、卵巢癌、宫颈癌等适应症。在中国,2010年2月贝伐珠单抗注射液获准进口注册,目前已经批准的适应症仅包括结直肠癌和非小细胞肺癌。贝伐珠单抗注射液原研产品的欧洲专利权于2019年到期,美国专利权于2017年到期,中国专利权已于2018年到期。
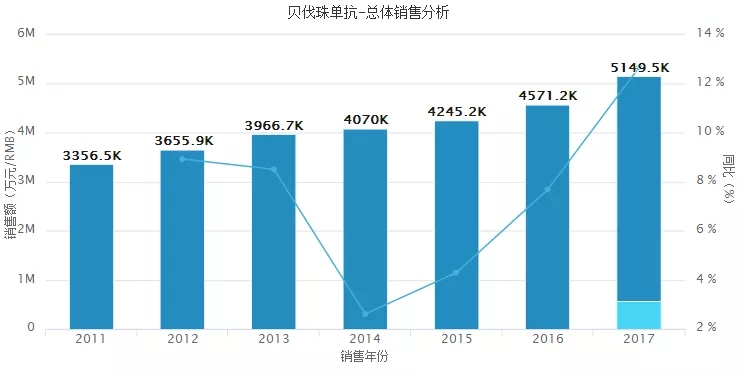
贝伐珠单抗自进入中国以来,销售额迅速攀升,上图显示了该药2011年-2017年总体销售情况。其中2017年贝伐珠单抗在中国市场为罗氏创收为1亿美元,占比全球市场销售额的1.5%左右。
据Igeahub公司发布的《2018年全球最畅销药物TOP20榜单》中,Avastin(贝伐珠单抗)以68.08亿美元的销售额位列榜单第6名。此外,相关医药人士预测,在2019年全球畅销药物TOP10中,Avastin将以68.11亿美元,占据第9位。
贝伐珠单抗展现了广阔的市场前景,其相关生物类似物自然也是各企业争相追逐的产品。就国内情况而言,现对贝伐珠单抗生物类似物提交上市申请的有齐鲁制药(2018年8月)、信达生物,而上海复宏汉霖(复星医药)、三生国健药业、百奥泰等企业研发的贝伐珠单抗生物类似药均处于临床阶段。
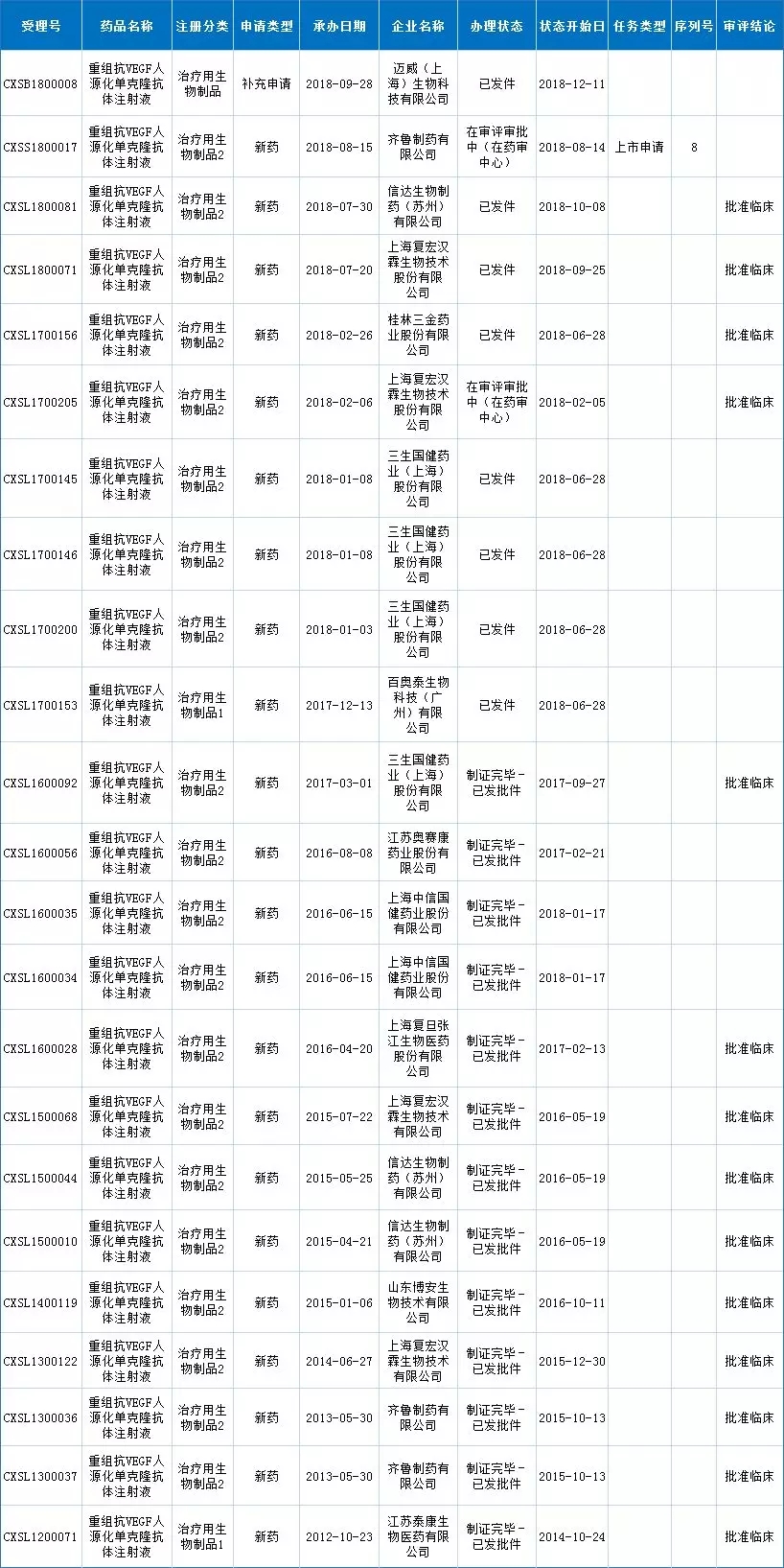
注:信达生物贝伐珠单抗注射液生物类似药(IBI-305)新药上市申请CDE官网还未公布,表格中暂时未录入










 国家监管
国家监管  正品保障
正品保障  价格实惠
价格实惠  专业服务
专业服务  闽公网安备35020302033421号
闽公网安备35020302033421号