1月25日,复星医药发布公告称,近日其控股子公司江苏万邦生化医药收到国家药品监督管理局颁发的关于格列美脲片的《药品补充申请批件》(批件号:2019B02139、2019B02156),该药品通过仿制药一致性评价。与此同时,四川汇宇制药的新4类仿制药多西他赛注射液获国家药监局批准上市(批准文号:国药准字H20193016),按照国家相关政策要求,该药品视同通过一致性评价,四川汇宇该品种成国内首家过评企业。
格列美脲片
格列美脲片适用于控制饮食、运动疗法及减轻体重均不能满意控制血糖的2型糖尿病。根据IQVIACHPA最新数据,2017年度,格列美脲片于中国境内销售额约为人民币9.7亿元。江苏万邦该药品于中国境内(不包括港澳台地区,下同)销售额约为人民币24,607万元(未经审计)。
另外据国际糖尿病联盟数据显示,2017年我国糖尿病患者人数达1.144亿人(20-79岁),为全球第一。据预测,抗糖尿病药物市场将从2017年的人民币512亿元增长至2028年的人民币1739亿元,复合年增长率为11.8%。
据药智数据,目前国产格列美脲片市场批文有16条,涉及扬子江药业、江苏万邦山东新华制药等11家企业,申报一致性评价的企业有8家,其中扬子江药业首家通过,此次江苏万邦第二家通过,有望在进一步拓宽市场销售,且在集中采购等方面有能够优先中选。
格列美脲片一致性评价申报受理详情表

多西他赛注射液
多西他赛注射液是一种微管抑制剂,主要用于治疗先期化疗失败的晚期或转移性乳腺癌、以顺铂为主的化疗失败的晚期或转移性非小细胞肺癌。由Sanofi-Aventis公司开发,是临床常用的抗肿瘤药,2017年在国内抗肿瘤药销售榜中,排名第三。 据网上公开数据显示,国内等级医院年销售额约34亿元,恒瑞医药占据主导地位。
据药智数据,国产市场批文有39条,生产企业20家,四川汇宇于2017年底,按新4类提交多西他赛注射液上市申请,2018年该药品被纳入优先审评。
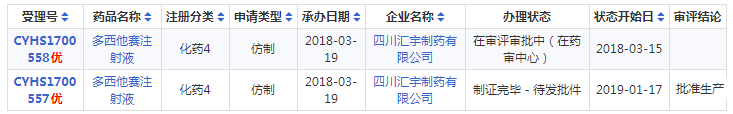
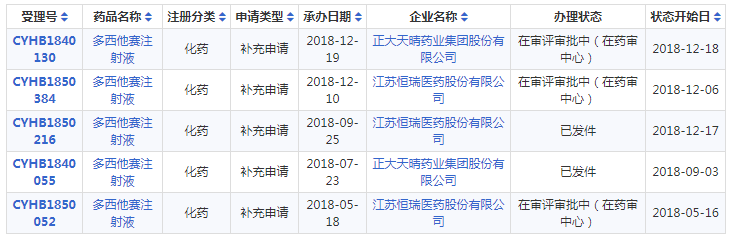
此外,截止目前,申报多西他赛注射液一致性评价的企业有正大天晴、江苏恒瑞,两家企业均已有受理号审批完毕“已发件”,却迟迟未有过评讯息传来,此次四川汇宇弯道超车、捷足先登,拔得头筹,获政策红利的同时扩展市场销售。











 国家监管
国家监管  正品保障
正品保障  价格实惠
价格实惠  专业服务
专业服务  闽公网安备35020302033421号
闽公网安备35020302033421号